Die Probe für die Phosphorsäurebestimmung wird ebenfalls in flüssiger Form ausgegeben, daher ist auch für diese Übung ein sauberer 250 mL Messkolben einzureichen, welcher nach Erhalt der Probe mit deionisiertem Wasser bis zur Marke aufzufüllen ist.
Bevor mit der Titration der Phosphorsäure begonnen werden kann, muss der Titer der für die Analyse benötigten NaOH (0,04N Natronlauge, welche aus einer ungefähr 0,1N NaOH hergestellt werden muss) gestellt werden. Dafür wird eine exakt abgewogene Menge an Kaliumhydrogenphthalat (Urtitersubstanz, MG = 204,224 g/mol) im Wägedöschen eingewogen, quantitativ in einen Titrierkolben überführt und in etwa 15mL destilliertem Wasser gelöst. Als Indikator für die Bestimmung des Äquivalenzpunkts bei der Titration mit 0.04N NaOH dienen 1-2 Tropfen alkoholische Phenolphthalein- Lösung. Zu beachten ist, dass nur trockenes Salz eingewogen werden soll, dieses wird von den Laboranten bereitgestellt und muss stets im Exsiccator aufbewahrt werden. Die folgende Abbildung 6 zeigt das für das Stellen des Titers benötigte Inventar. Der Umschlag von Phenolphtahlein erfolgt von farblos (sauer) zu leicht rosa (basisch). Die rechte Abbildung zeigt die Farbe der Lösung nach dem Umschlag (es wurde bewusst übertitriert, um für das Foto eine ausreichend intensive Farbe zu erhalten. Tatsächlich wäre ein ganz leichter violett-Ton optimal).



Um einen Verbrauch von etwa 10mL 0,04N NaOH zu erzielen, wird eine Einwaage von etwa 80mg Kaliumhydrogenphthalat benötigt. Aus dem theoretischen Verbrauch und dem tatsächlich gemessenen Verbrauch lässt sich anhand der verwendeten Einwaage an Kaliumhydrogenphthalat die wahre Konzentration der Natronlauge bestimmen.
Für die Phosphorsäurebestimmung werden nun 25ml der gut homogenisierten Probelösung in einem 150ml-Becherglas mit Wasser verdünnt, bis das Glas ca. halbvoll ist. Die saubere Rührbohne lässt man vorsichtig an der Wand entlang in das Becherglas gleiten. Am Magnetrührer sollte das Glas zentriert aufgestellt werden und die Rührleistung langsam gesteigert werden, um ein Herausspringen der Rührbohne zu verhindern. Nun wird die pH- Elektrode in die Lösung getaucht, wobei besonders darauf zu achten ist, dass es zu keiner Berührung mit der Rührbohne kommt (Bruch der Elektrodenspitze!). Die Glaselektrode ist ohne der weißen Schutzhülle aus Kunststoff zu verwenden. Die Rührleistung sollte so gewählt werden, dass eine gute Durchmischung der Lösung möglich ist (maximal Stufe 4). Es ist jedoch darauf zu achten, dass keine Flüssigkeit verspritzt wird. Der apparative Aufbau ist in der nachstehenden Abbildung 7 dargestellt. Nach Gebrauch muss die Glaselektrode wieder in der mit Wasser oder Kaliumchlorid-Lösung gefüllten Kappe (verhindert das Austrocknen der Oberfläche und bietet Schutz gegen Bruch) aufbewahrt werden! Eine trockene Elektrodenoberfläche reagiert nur langsam auf pH- Änderungen und gibt unter Umständen falsche Resultate.

Nach Einschalten des pH-Meters titriert man die vorgelegte Phosphorsäure zügig mit der NaOH bis ca. 1,5ml vor dem zu erwartenden 1. Äquivalenzpunkt (ÄP). Das setzt natürlich eine erste orientierende Bestimmung voraus. Dann wird NaOH in exakten 0,1ml Portionen zugegeben (Bürettenspitze abspülen, nichts verspritzen, darauf achten, dass die abgelesene Menge tatsächlich der zugegebenen Menge entspricht). Man trägt die pH- und Verbrauchswerte in eine Tabelle ein. Auf diese Weise titriert man weiter, bis ca. 1,5 ml nach dem 1. ÄP. Genauso geht man beim 2. ÄP vor.
Nach Zugabe der 0,1ml-Portionen wartet man jeweils kurz, bis sich der angezeigte pH-Wert nicht oder nur mehr ganz langsam ändert. Dies dauert im Bereich um die Äquivalenzpunkte etwas länger. Die gesamte Titration (1. ÄP plus 2. ÄP) darf aber auf keinen Fall länger als 20 bis maximal 25 Minuten dauern (Warum?).
Würde man die erhaltenen Messdaten grafisch darstellen, wäre eine Bestimmung der beiden ÄP nur schwer möglich, da der Wendepunkt in der sigmoidalen Titratinskurve schlecht zu erkennen ist (s. Abbildung 7, kleine Abbildung). Deshalb wird die „Ableitung“ der Kurve gebildet, weil hier der Wendepunkt als Maximum deutlich hervortritt. Dafür werden die ΔpH-Werte berechnet und den Mittelwerten des jeweiligen Zugabeintervalles zugeordnet (siehe Tabelle 1). Der ÄP wird dann grafisch bestimmt. Dabei ist der gesamte Kurvenverlauf um den ÄP herum (ca. 1,5 ml davor und danach) und nicht nur der höchste Einzelwert zu berücksichtigen. (s. Abbildung 8, der ÄP liegt in diesem Beispiel zwischen den beiden höchsten Punkten).
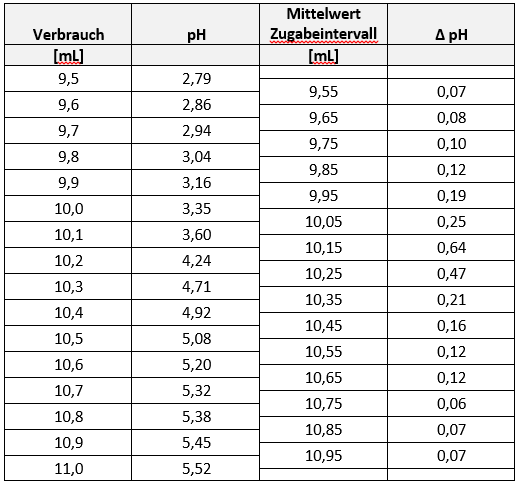
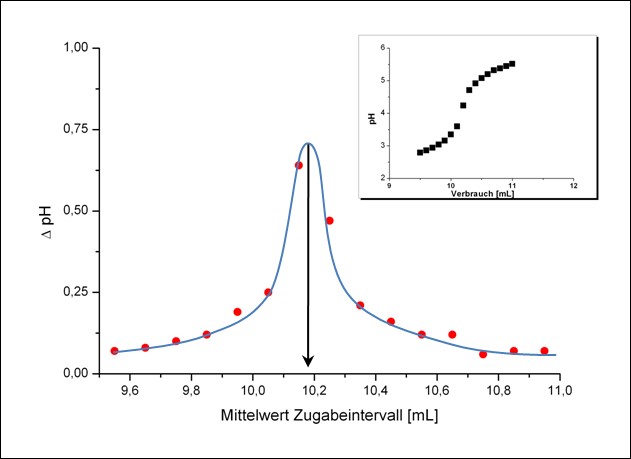
Der Verbrauch bis zum ersten ÄP entspricht dem ersten Proton der h3PO4, die Differenz zwischen zweitem und erstem ÄP dem zweiten Proton der h3PO4. Berechnen Sie das Ergebnis sowohl für den 1. als auch für den 2. Äquivalenzpunkt und wählen Sie daraus das korrekte Ergebnis als Endergebnis Ihrer Analyse aus.